Всего за 54.99 руб. Купить полную версию
Умеренная форма от ≥15 и <30
Тяжелая форма ≥30
Применение именно этих пограничных значений в классификации степени тяжести СОАС основывается на результатах крупных проспективных контролируемых исследований, которые показали достоверное увеличение частоты сердечно-сосудистых осложнений при ИАГ >15 в 2–3 раза и при ИАГ >30 в 5–6 раз [7, 11, 13].
Остановка дыхания обструктивного или центрального генеза, если она длится достаточно долго, сопровождается кратковременным эпизодом снижения насыщения артериальной крови кислородом с последующим возвратом сатурации к исходной величине. Клинически значимой считается десатурация на 3 % и более. При повторяющихся апноэ во сне на кривой сатурации отмечаются циклические десатурации (рис. 3). В верхней части рис. 3 располагаются статистические данные по исследованию, в средней – 8-часовая развертка кривых SpO2 и пульса, в нижней – 15-минутная развертка кривых SpO2 и пульса.
На графике SpO2 отмечается классическая картина циклических резких десатураций, обусловленных апноэ / гипопноэ. ИД 53,5 в час, что указывает на тяжелую форму апноэ сна. Минимальная сатурация 70 %. При этом средние показатели SpO2 лишь незначительно снижены (90,6 %), что указывает на отсутствие значимой хронической ночной гипоксемии другого генеза. Вне эпизодов десатураций насыщение крови кислородом достигает нормы. Отмечаются выраженные колебания пульса (от 53 до 70 в мин), связанные с периодами десатураций.
Эпизоды апноэ могут продолжаться до минуты и более, что сопровождается резким снижением сатурации, которая быстро восстанавливается до нормы в вентиляционную фазу после апноэ (рис. 4). Следует заметить, что при сатурации ниже 70 % развивается диффузный цианоз. Интересен тот факт, что у обычного человека при волевой задержке дыхания сатурация снижается максимум на 5–7 %, далее человек не выдерживает и начинает дышать.
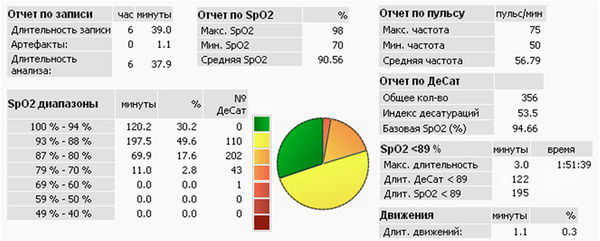
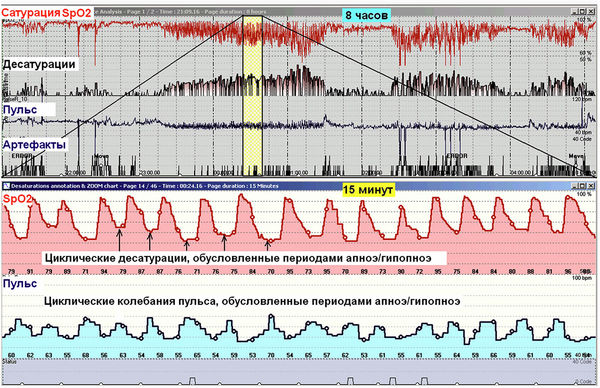
Рис. 3. Пациент З., 49 лет, тяжелая форма синдрома обструктивного апноэ сна, ожирение 3-й ст.
Картина циклических десатураций высоко специфична для синдрома апноэ во сне. Ни одно другое патологическое состояние не дает таких характерных изменений сатурации. Как отмечалось, наиболее частыми патологическими состояниями, проявляющимися циклическими апноэ, являются синдром обструктивного апноэ сна и дыхание Чейна – Стокса.
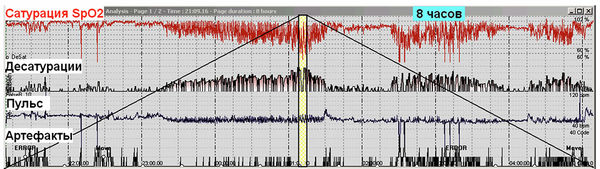
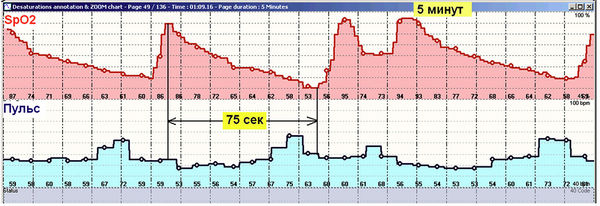
Рис. 4. Пациент З., 49 лет. Отмечено обусловленное апноэ падение сатурации с 90 % до 53 % (на 37 %!) продолжительностью 75 секунд
При обструктивных апноэ отмечается пологий спад и быстрый подъем сатурации в вентиляционную фазу, т. к. происходит резкое возобновление дыхания при открытии дыхательных путей.
При центральных апноэ нисходящее и восходящее колено эпизода десатурации практически равны по длительности, т. к. развитие апноэ обусловлено нарушением работы дыхательного центра, который достаточно плавно тормозится и также медленно восстанавливает свою активность.
Таким образом, вентиляция возобновляется постепенно, соответственно, восстановление сатурации также происходит достаточно плавно. Визуальный анализ кривых сатурации позволяет в определенной степени различать обструктивные и центральные апноэ. Но точный дифференциальный диагноз проводится на основании кардио-респираторного мониторинга или полисомнографии (ПСГ).
Подсчет ИД позволяет, фактически, судить об ИАГ. Таким образом, МКП с достаточной точностью позволяет предположить наличие и тяжесть синдрома апноэ во сне.
До настоящего времени в научных кругах идет активная дискуссия о целесообразности применения МКП для скрининговой диагностики апноэ сна в целом, и СОАС в частности. Высказываются мнения от полного неприятия данного метода до возможности его использования не только в качестве скринингового метода, но и для установления точного клинического диагноза СОАС. МКП, как скрининговый метод, естественно, имеет и плюсы, и минусы. Основной претензией противников МКП является низкая, по их мнению, чувствительность метода, то есть часть пациентов с имеющимся СОАС остается недиагностированной и, следовательно, нелеченной. Чувствительность и специфичность МКП в выявлении СОАС исследовалась в большом количестве работ и колебалась в широком диапазоне. По данным различных авторов, значения чувствительности составляют от 31 до 98 %, специфичности – от 41 до 100 % [19].
Следует отметить, что в ряде исследований, которые выявляли недостаточную чувствительность МКП, как правило, использовалась низкая частота оцифровки сигнала (например, каждые 12 секунд), то есть пульсоксиметр в течение 12 секунд измерял сатурацию, далее усреднял данные и записывал в память усредненное значение за весь период измерения. Так как при эпизодах апноэ / гипопноэ отмечаются достаточно быстрые изменения сатурации, то при данной частоте регистрации сигнала недооценивается много случаев клинически значимого СОАС.
Данный вывод подтверждают результаты исследования, в котором у пациента одновременно проводилась ПСГ и ночная пульсоксиметрия тремя идентичными пульсоксиметрами с частотой регистрации сигнала 3, 6 и 12 секунд. Была показана достоверная разница в индексах десатураций (p<0,01), зарегистрированных всеми тремя пульсоксиметрами. Минимальное значение индекса десатураций было при регистрации сигнала раз в 12 секунд. Это, в свою очередь, приводило к различной клинической интерпретации результатов пульсоксиметрии врачом. Таким образом, при проведении МКП с целью детекции апноэ целесообразно устанавливать минимальный интервал измерений (не более 4 секунд, в идеале 1 секунда). Важно также наличие в пульсоксиметрах алгоритмов, которые эффективно устраняют двигательные артефакты на кривой сатурации.
Интересно отметить, что в клинически различных группах пациентов показатели чувствительности и специфичности МКП существенно различаются. Так, B. G. Cooper et al. показали, что чувствительность и специфичность МКП зависит от ИАГ. У пациентов с ИАГ >25 в час чувствительность МКП была 100 %, специфичность – 95 %, у пациентов с ИАГ > 15 в час значения снизились до 75 % и 86 %, при ИАГ > 5 в час – до 60 % и 80 % соответственно. Авторы сделали вывод, что МКП является эффективным методом скринирования пациентов со среднетяжелыми формами СОАС, но недостаточно точна при диагностике легких форм заболевания.
В другой работе одновременно проводили ПСГ и МКП и показали, что если брать за пороговое значение ИД >15 (при величине десатураций >3 %), то чувствительность и специфичность для выявления ИАГ >20 по данным ПСГ составила 90 % и 100 % соответственно. Таким образом, авторы сделали вывод, что при выявлении ИД>15 в час можно с достаточно высокой степенью достоверности утверждать, что у пациента имеется среднетяжелая форма СОАС. Другие авторы показали, что если бы анализ выполнялся только на основании МКП, то было бы пропущено только 15 % пациентов со среднетяжелой формой СОАС [19].
С практической точки зрения можно сделать вывод, что МКП вполне может применяться для выявления средних и тяжелых форм СОАС, даже при условии, что каждый 7-й пациент со среднетяжелой формой СОАС будет пропущен. Но и это будет уже огромным шагом вперед по сравнению с текущей ситуацией, когда СОАС в отечественном практическом здравоохранении не диагностируется вообще.
Чувствительность МКП при выявлении легких форм СОАС относительно невысока. Следует, однако, отметить, что легкая форма, во-первых, не несет значительных сердечно-сосудистых рисков, во-вторых, переносимость CPAP -терапии у таких пациентов низка.
Таким образом, даже если мы и не диагностируем методом МКП часть пациентов с легкой формой СОАС, то это не будет иметь катастрофических последствий в отношении прогноза их жизни или неназначения им СРАР -терапии – наиболее эффективного метода лечения СОАС, т. к. пациенты, скорее всего, от него откажутся из-за отсутствия выраженных симптомов заболевания.
До настоящего времени продолжается и дискуссия о том, какую частоту десатураций в час считать клинически значимой. Разные авторы указывают на различное патологическое пороговое значение: 5 десатураций в час, 10 десатураций в час или 15 десатураций в час. Но ни у одного из авторов не возникает сомнений, что ИД>15 является очевидно патологическим и требует серьезного внимания.
Еще одним важным критерием целесообразности применения любой диагностической методики является прогностическая ценность положительного результата (ПЦПР). Формула, связывающая чувствительность и распространенность заболевания с ПЦПР, выводится из теоремы Байеса:
ПЦПР = (Ч×P) / [(Ч×P) + (1 – Ч)×(1 – P)],
где ПЦПР – прогностическая ценность положительного результата;
Ч – чувствительность;
P – распространенность.