Всего за 199 руб. Купить полную версию
В июне 1922 года Бор посетил университет Геттингена в Германии и прочитал серию лекций по квантовой теории и атомной структуре. Под руководством Макса Борна, который в 1921 году получил там звание профессора теоретической физики, Геттинген стал одним из трех ключевых центров развития полноценной версии квантовой механики. Борн родился в 1882 году и был сыном профессора анатомии университета Бреслау. В начале 1900-х годов, когда появились первые идеи Планка, он еще был студентом. Сперва он изучал математику, а к физике обратился после завершения своей докторской в 1906 году (и некоторое время проработал в Кавендишской лаборатории). Как мы увидим, это дало ему важные навыки. Будучи экспертом в теории относительности, Борн писал работы с исключительной математической точностью, что сильно отличалось от запутанных теоретических набросков Бора, которые содержали блестящие идеи и физическую интуицию, но зачастую требовали доработки в математической части. Однако оба гения были важны для нового понимания атомов.
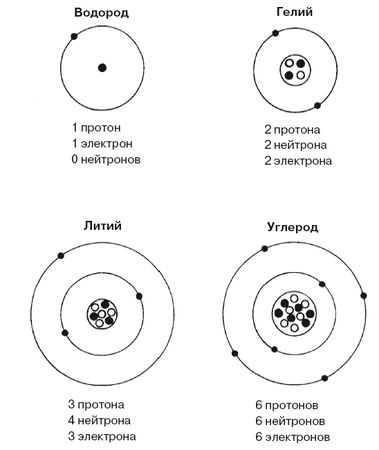
Рис. 4.2. Атомы некоторых простейших элементов зачастую можно представить как ядро, окруженное электронами в оболочках, соответствующих энергетическим уровням. Квантовые законы позволяют только двум электронам находиться на нижнем уровне, поэтому литий, имеющий три электрона, имеет один электрон на второй ступени энергетической лестницы. Вторая оболочка может "вместить" восемь электронов, поэтому у углерода она заполнена ровно наполовину, что является причиной его интересных химических свойств, лежащих в основе жизни.
Лекции Бора в июне 1922 года стали важной вехой в возрождении физики в послевоенной Германии, а также в истории квантовой теории. На них присутствовали ученые со всей Германии, и лекции прозвали "Фестивалем Бора" (с намеком на некоторые другие известные немецкие праздники). На этих лекциях, сперва подготовив себе почву, Бор представил первую успешную теорию о Периодической таблице, которая в сущности дожила и до наших дней. Идея Бора основывалась на том, как электроны окружают ядро атома. Каким бы ни было атомное число этого ядра, первый электрон отправляется на энергетический уровень, соответствующий основному уровню водорода. Следующий электрон оседает на том же самом энергетическом уровне, и внешне атом уже походит на атом гелия, обладающего двумя электронами. Бор утверждал, что на этом уровне больше нет места для электронов, а потому следующий электрон должен осесть на другом энергетическом уровне. Таким образом, атом с тремя протонами в ядре и тремя электронами вне ядра должен содержать два электрона, посаженных ближе к ядру, и один – чуть дальше. В химическом отношении он должен вести себя подобно атому с одним электроном (атому водорода). Элемент с Ζ = 3 – это литий, который действительно проявляет некоторое химическое сходство с водородом. Следующий элемент Периодической таблицы, свойства которого сходны со свойствами лития, – это натрий (Ζ = 11), находящийся на восемь клеток дальше лития. В связи с этим Бор заявил, что на энергетических уровнях, расположенных дальше двух внутренних электронов, должно быть восемь мест. Когда они заполняются, следующий электрон, одиннадцатый по счету, должен оседать на следующем энергетическом уровне, связанном с ядром еще слабее, снова копируя внешний вид атома с одним-единственным электроном.
Эти энергетические уровни называются "оболочками". Объяснение Периодической таблицы, предложенное Бором, с успехом включало в себя заполнение оболочек по мере увеличения Ζ. Оболочки можно представить себе в виде луковицы, имеющей много слоев. Химические свойства определяются числом электронов на внешней оболочке атома. Находящееся глубже играет второстепенную роль в том, как один атом взаимодействует с другими.
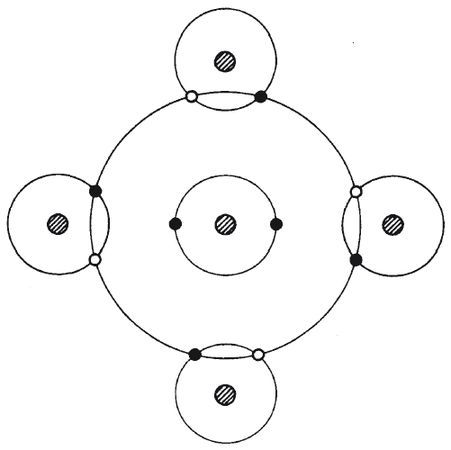
Рис. 4.3. Когда один атом углерода создает связь с четырьмя атомами водорода, электроны распределяются так, что у каждого атома водорода как будто заполняется первая оболочка (два электрона) и каждый атом углерода "видит" на своей второй оболочке восемь электронов. Это очень стабильная конфигурация.
Бор шел по электронным оболочкам от ядра атома к его периферии, используя все свидетельства, предоставленные спектроскопией, и объяснил взаимосвязь элементов в периодической системе с точки зрения атомной структуры. Он понятия не имел, почему оболочка, содержащая восемь электронов, должна была считаться заполненной ("замкнутой"), но не оставил ни у кого из своих слушателей сомнения в том, что открыл основополагающую истину. Как позже сказал Гейзенберг, Бор "ничего не доказал математически… он просто понял, что связь была примерно такой". В 1949 году, комментируя успех работы Бора, основанной на квантовой теории, в своих "Автобиографических заметках", Эйнштейн написал: "Это неустойчивое и противоречивое основание оказалось достаточным, чтобы позволить человеку, обладающему таким уникальным чутьем и здравым смыслом, как Бор, открыть основные законы спектральных линий и электронных оболочек атома, описав одновременно их влияние на химию, и это показалось мне истинным чудом – и кажется чудом даже сегодня".
Химия изучает, как атомы взаимодействуют и объединяются, образуя молекулы. Почему углерод взаимодействует с водородом так, что четыре атома водорода объединяются с одним атомом углерода, образуя молекулу метана? Почему водород существует в форме молекул, каждая из которых состоит из двух атомов, тогда как атомы гелия не образуют молекул? И так далее. Оболочечная модель дала поразительно простые ответы. Каждый атом водорода имеет один электрон, тогда как у гелия их два. "Самая глубокая" оболочка заполняется, когда на ней оказываются два электрона. По неизвестной причине заполненные оболочки более стабильны – атомы "любят" заполненные оболочки. Когда два атома водорода объединяются, образуя молекулу, они делятся друг с другом электронами таким образом, что каждый атом выигрывает, получая замкнутую оболочку. Гелий уже обладает замкнутой оболочкой, поэтому он не заинтересован в таком взаимодействии и отказывается вступать с чем-либо в химическую связь.
Ядро углерода содержит шесть протонов, а рядом с ним находится шесть электронов. Два из них расположены на замкнутой внутренней оболочке, а четыре – на внешней, что делает ее наполовину пустой. Четыре атома водорода могут вступить во взаимодействие с четырьмя внешними электронами углерода и поделиться собственными электронами. Каждый атом водорода получает в итоге псевдозамкнутую оболочку с двумя внешними электронами, в то время как атом углерода получает псевдозамкнутую вторую оболочку с восемью электронами.
Бор утверждал, что атомы объединяются таким образом, чтобы как можно ближе подойти к созданию замкнутой внешней оболочки. Иногда, как в случае с молекулой водорода, лучше всего представить себе пару электронов, которые являются общими для двух ядер; в других случаях удобнее представить атом, имеющий один электрон на внешней оболочке (например, атом натрия), который отдает этот электрон другому атому, имеющему на внешней оболочке семь электронов и одно свободное место (в этом случае, например, атому хлора). Все атомы довольны: натрий, теряя электрон, позволяет более глубокой, но при этом заполненной оболочке стать "видимой", а хлор, получая электрон, заполняет свою внешнюю оболочку. Однако итоговый результат заключается в том, что атом натрия, теряя одну единицу отрицательного заряда, становится положительно заряженным ионом, а атом хлора становится отрицательно заряженным ионом. Так как противоположные заряды притягиваются, атомы остаются связанными в форме электрически нейтральной молекулы хлорида натрия, или обыкновенной соли.
Таким образом можно объяснить все химические реакции: фактически они представляют собой перераспределение электронов между атомами в целях достижения стабильности заполненных электронных оболочек. Энергетические переходы с участием внешних электронов дают характерный спектральный отпечаток элемента, в то время как энергетические переходы, в которых задействованы более глубокие оболочки (а следовательно, гораздо больше энергии, в рентгеновской части спектра), должны быть одинаковыми для всех элементов, что и было доказано. Как и все лучшие теории, модель Бора была подтверждена успешным предсказанием. Элементы были расставлены в Периодической таблице, но даже в 1922 году в ней существовало несколько пропусков, соответствующих еще не открытым элементам с атомными числами 43, 61, 72, 75, 85 и 87. Модель Бора точно предсказала свойства этих "недостающих" элементов и предположила, что элемент 72, в частности, должен был иметь свойства, схожие со свойствами циркония, а этот прогноз противоречил предсказаниям, сделанным на основе альтернативных моделей атома. Прогноз подтвердился в течение года, когда был открыт гафний, элемент 72, спектральные свойства которого в точности соответствовали предсказанным Бором.