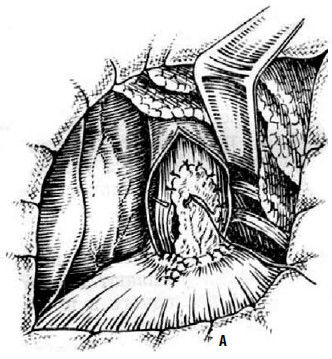
Рис. 19. Рентгенологические симптомы кардиоспазма: А – пищевод значительно расширен, удлинен и смещен вправо; дистальный его отрезок резко сужен, газовый пузырь желудка отсутствует; Б – справа в верхней доле легкого явления пневмосклероза как следствие многократных аспирационных пневмоний. (Приводится по: Е.М. Каган. Рентгенодиагностика заболеваний пищевода. М., 1968)
Дифференциальная диагностика
Кардиоспазм дифференцируют с опухолями пищевода и кардиального отдела желудка, рубцовыми стенозами и дивертикулами пищевода, грыжей пищеводного отверстия диафрагмы (ГПОД). Все эти заболевания имеют сходную клиническую симптоматику, а в качестве ведущего симптома выступает дисфагия.
Злокачественные опухоли пищевода и кардии встречаются значительно чаще кардиоспазма. Обычно заболевают люди старше 50–60 лет, тогда как ахалазией страдают более молодые пациенты. Рак развивается в течение нескольких месяцев и сопровождается прогрессирующей дисфагией, параллельным ухудшением общего состояния (нарастанием слабости, потери массы тела, вплоть до истощения, анемии), тогда как кардиоспазм – длительное заболевание с медленным течением и годами сохраняющимся хорошим общим состоянием пациентов.
Сужение кардии при раке может сопровождаться супрастенотическим расширением пищевода, что бывает и при кардиоспазме. Однако для рака характерно нарушение целости контура стенки пищевода и желудка с образованием дефекта наполнения. Стенозированный участок при этом бывает неровным, нечетким, как бы изъеденным. Эвакуация бария в желудок происходит непрерывной суженной струйкой. Газовый пузырь желудка при раке, в отличие от кардиоспазма, хорошо выявляется (рис. 20).
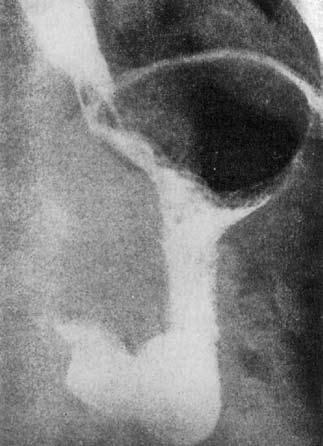
Рис. 20. Сужение пищеводножелудочного перехода при раке кардиального отдела желудка. Газовый пузырь желудка виден отчетливо. (Приводится по: Б. Е. Петерсон. Рак проксимального отдела желудка. 1972)
При ГПОД более выражен болевой синдром, жгучие боли локализуются за грудиной и в эпигастрии. Дисфагия редко бывает тяжелой, регургитация обычно отсутствует. В рентгенологической картине может быть сходство с кардиоспазмом I стадии. Для дифференциальной диагностики необходимо провести исследование в горизонтальном положении, при котором легко можно увидеть скользящую ГПОД. У некоторых больных симптомы дивертикула пищевода сходны с таковыми при кардиоспазме. Точный диагноз можно поставить на основании рентгенологического исследования.
В сложных и диагностически неясных случаях для уточнения диагноза показано проведение КТ грудной и брюшной полости, а также эндосонографии пищевода.
Лечение
При I–II стадиях кардиоспазма проводят консервативное лечение. Ведущее место в лечении III–IV стадии заболевания принадлежит хирургическим методам.
Консервативное лечение. Для лечения кардиоспазма применяли множество лекарственных препаратов из самых разных фармакологических групп. Однако более или менее клинически успешным оказалось использование только двух из них: нитратов и блокаторов кальциевых каналов. Эти препараты снижают тонус НПС и облегчают глотание. Считается, что нитраты более эффективны, но имеют труднопереносимый побочный эффект – сильную головную боль. Блокаторы кальциевых каналов (нифедипин, дилтиазем) переносятся больными существенно лучше. Новейшие исследования доказывают перспективность использования силденафила (виагры) в терапии нейромышечных заболеваний пищевода.
Лекарственное лечение кардиоспазма лучше применять на ранних стадиях и при так называемом первом типе болезни, когда перистальтика гладкой мускулатуры пищевода еще сохранена.
На практике, когда лекарственное лечение не дает должного клинического эффекта (а это бывает нередко), "стартовым" методом лечения наиболее часто является кардиодилатация (КД). Сущность ее заключается в насильственном растяжении и частичном разрыве мускулатуры дистального сегмента пищевода.
В прошлом широко применялся металлический кардиодилататор Штарка, в котором есть 4 расширяющиеся бранши, присоединенные к металлическому стержню. На противоположном конце укреплена рукоятка с кремальерой, обеспечивающей дозированное раскрытие браншей (рис. 21).
Современные кардиодилататоры состоят из резинового или полихлорвинилового зонда с укрепленным на его конце баллоном (рис. 22).
Дилататор вводят под рентгенологическим или эндоскопическим контролем. Баллон наполняют воздухом или водой; при этом достигают определенного уровня давления. Технические детали вмешательства (вид анестезии, длительность экспозиции дилататора, режим повторных КД) широко варьируют в разных клиниках. Так, в нашей клинике в течение многих лет с успехом применялась КД резиновым гидродилататором под давлением 300 мм рт. ст. с экспозицией 1 час. Вмешательство осуществлялось под общей анестезией.

Рис. 21. Кардиодилататор Штарка. (Приводится по: 0. Д. Федорова. Кардиоспазм. М., 1973)
В большинстве случаев после КД наблюдается улучшение в виде облегчения глотания и регресса других симптомов заболевания. В поздних стадиях кардиоспазма (III–IV) нередко возникают показания к операции, поскольку КД малоэффективна или опасна ввиду высокого риска разрыва пищевода.
Наиболее распространенными операциями при кардиоспазме являются эзофагокардиомиотомия (операция Геллера) и ее многочисленные модификации. Рассечение мышечной оболочки дистального отрезка пищевода устраняет нерасслабление НПС при глотании. Современный вариант операции Геллера предусматривает рассечение мышечной оболочки вертикальным разрезом на передней стенке пищевода с небольшим (1–2 см) заходом на кардию (рис. 23).
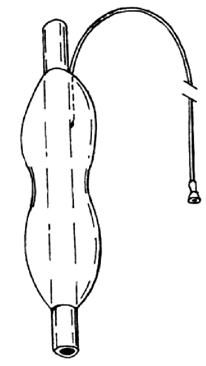
Рис. 22. Баллонный пневмокардиодилататор, надеваемый на дистальную часть эндоскопа. (Приводится по: Ю.И. Галлингера, Э.А. Годжелло. Оперативная эндоскопия пищевода. М., 1999)
Многие хирурги для достижения более надежного результата иссекают полоску пищеводной стенки. Эзофагокардиомиотомию можно выполнять как абдоминальным, так и торакальным доступом. 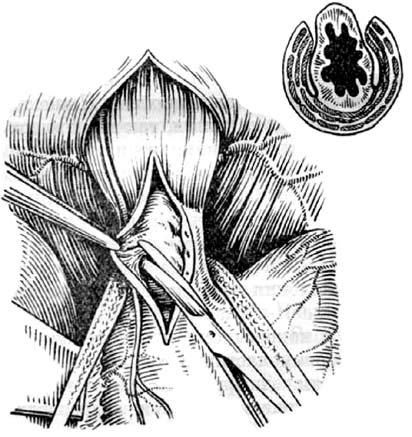
Рис. 23. Эзофагокардиомиотомия по Геллеру. Этап отделения слизистой оболочки от мышечного слоя пищевода и кардии. (Приводится по: А. А. Шалимов и соавт. Хирургия пищевода. М., 1975)
Однако технически безупречное производство операции Геллера возможно далеко не всегда. При значительных склеротических изменениях стенки пищевода полноценную миотомию выполнить трудно. Высок риск случайного повреждения слизистой, что приводит к развитию после операции медиастинита и/или перитонита. В отдаленном периоде может образоваться эпифренальный дивертикул пищевода вследствие пролабирования слизистой через миотомическое отверстие. Нередко возникает ретракция рассеченных тканей с дальнейшим рубцеванием, что ведет к рецидиву дисфагии. Избыточная миотомия влечет за собой развитие тяжелого рефлюкс-эзофагита. Для устранения недостатков оригинальной операции были предложены ее модификации, которые предусматривали укрытие миотомического отверстия: при способе Б. В. Петровского – лоскутом, выкроенным из диафрагмы, В. И. Колесова – сальником на ножке (рис. 24 и 25).
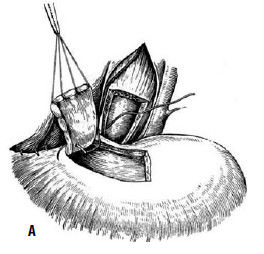
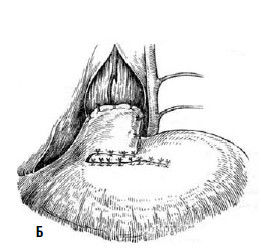
Рис. 24. Эзофагокардиопластика диафрагмальным лоскутом по Б.В. Петровскому: А – иссечен участок мышечного слоя пищевода, сформирован диафрагмальный лоскут, начато подшивание последнего к мышечным краям пищевода; Б – лоскут фиксирован, дефект в диафрагме ушит. (Приводится по: О. Д. Федорова. Кардиоспазм. М., 1973)
Однако отдаленные исходы и таких операций оказались не очень хорошими – в первую очередь, вследствие грубого рубцевания перемещенных лоскутов. Гораздо лучшим способом оказалось укрытие линии разреза передней стенкой дна желудка, которую поворачивают на 180♦ (рис. 26).