На молекуле ДНК на небольшом расстоянии до стартовой точки транскрипции имеются короткие специфические последовательности: ЦААТ-элемент, ЦГ-бокс и октамерный бокс, узнающие факторы транскрипции. Эти элементы есть во всех клетках, и постоянно транскрибируемые гены нуждаются только в них. В то же время для генов, подвергающихся адаптивной регуляции, обнаружены участки молекулы ДНК, более удаленные от промотора, но тоже участвующие в транскрипции. Эти нуклеотидные последовательности бывают двух типов. Энхансеры – участки ДНК, присоединение к которым регуляторных белков увеличивает скорость транскрипции. Если же участки ДНК, связываясь с белками, обеспечивают замедление транскрипции, то их называют сайленсерами (Рис. 6.4).
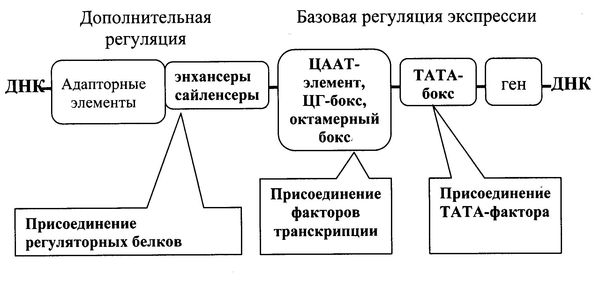
Рис. 6.4. Организация регуляторных блоков транскрипции
Процессинг РНК
Все виды РНК синтезируются в виде предшественников и нуждаются в процессинге (созревании).
Процессинг мРНК начинается с кэпирования. Фермент гуанилилтрансфераза гидролизует макроэргическую связь в молекуле ГТФ и присоединяет нуклеозиддифосфатный остаток 5'-фосфатной группой к 5'-концу пре-мРНК с образованием 5,5'-фосфодиэфирной связи. Последующее метилирование остатка гуанина в составе ГТФ с образованием N7-метилгуанозина завершает образование кэпа. Модифицированный 5'-конец удлиняет время жизни мРНК, защищая её от действия 5'-экзонуклеаз в цитоплазме. Кэпирование важно для обеспечения инициации трансляции, так как инициирующие кодоны распознаются рибосомой только если присутствует кэп. Наличие кэпа необходимо для работы ферментной системы, обеспечивающей удаление интронов.
3'-конец пре-мРНК также подвергается модификации, при которой специальным ферментом полиА-полимеразой формируется полиА-последовательность, состоящая из 100–200 остатков адениловой кислоты. Наличие полиА-"хвоста" облегчает выход мРНК из ядра и замедляет её гидролиз в цитоплазме. Ферменты, осуществляющие кэпирование и полиаденилирование, избирательно связываются с РНК-полимеразой II, и в отсутствие полимеразы неактивны.
Первичный транскрипт представляет собой строго комплементарную матрице нуклеиновую кислоту, содержащую как кодирующие участки – экзоны, так и некодирующие – интроны. В ходе дальнейших стадий процессинга последовательности интронов "вырезаются" из первичного транскрипта, концы экзонов соединяются друг с другом. Такая модификация РНК называется сплайсингом. В результате сплайсинга из первичных транскриптов образуются молекулы "зрелой" мРНК.
Для некоторых генов описаны альтернативные пути сплайсинга и полиаденилирования одного и того же первичного транскрипта. Разные варианты сплайсинга могут приводить к образованию разных изоформ одного и того же белка. Например, ген тропонина состоит из 18 экзонов и кодирует многочисленные изоформы этого мышечного белка, которые образуются в тканях на разных стадиях их развития.
Процессинг тРНК заключается в формировании 3'-конца, удалении единственного интрона и модификациях азотистых оснований. Формирование акцепторного конца катализирует РНК-аза, представляющая собой 3'-экзонуклеазу, поочередно удаляющую нуклеотиды до достижения последовательности ЦЦА, одинаковой для всех тРНК. Для некоторых тРНК формирование последовательности ЦЦА происходит в результате присоединения этих нуклеотидов.
Процессинг рРНК. Гены рРНК транскрибируются РНК-полимеразой I с образованием идентичных первичных транскриптов (45S рРНК). В результате процессинга из этого предшественника образуются 3 типа рРНК: 18S, входящая в состав малой субъединицы рибосом, а также 28S и 5,8S, локализующиеся в большой субъединице. Остальная часть транскрипта разрушается в ядре. 5S рРНК большой субъединицы транскрибируется отдельно.
Обратная транскрипция
Некоторые РНК-содержащие вирусы (вирус саркомы Рауса, ВИЧ) обладают уникальным ферментом – РНК-зависимой ДНК-полимеразой, часто называемой обратной транскриптазой или ревертазой. Этот фермент обладает время активностями. Первая из них – РНК-зависимая ДНК-полимеразная. Она обеспечивает синтез одноцепочечной комплементарной ДНК на матрице РНК. Вторая – рибонуклеазная активность, обеспечивающая удаление цепи РНК. Третья активность – ДНК-зависимая ДНК-полимеразная, обеспечивающая синтез второй цепи ДНК.
В результате образуется ДНК которая содержит гены, обуславливающие развитие рака (онкогены). Эта ДНК встраивается в геном эукариотической клетки, где может в течение многих поколений оставаться в скрытом состоянии. При определенных условиях такие гены могут активироваться и вызвать репликацию вируса, при других же условиях они могут способствовать перерождению такой клетки в раковую. Вирусы с таким механизмом размножения индуцируют развитие опухолей у животных и человека, поэтому их еще называют онкогенными вирусами (Рис. 6.5.).
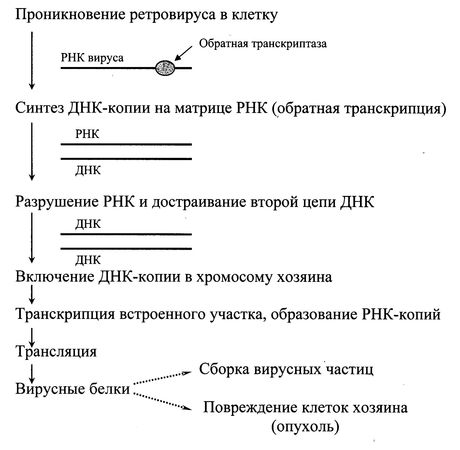
Рис. 6.5. Обратная транскипция
Глава 7. Биосинтез белка
Завершающий этап реализации генетической информации, заключающийся в синтезе полипептидных цепей на матрице мРНК, называется трансляцией. В результате этого процесса генетическая информация с языка последовательности нуклеотидов в мРНК переводится (транслируется) на язык последовательности аминокислот в молекуле белка. Роль своеобразного "словаря" при этом переводе выполняет генетический код. Это свойственная всем живым организмам единая система записи наследственной информации в виде нуклеотидной последовательности, которая определяет порядок включения аминокислот в синтезирующуюся полипептидную цепь.
Для генетического кода характерны следующие свойства:
1. триплетность – каждая аминокислота кодируется тремя нуклеотидами;
2. универсальность – код одинаков для всех организмов;
3. однозначность (специфичность) – каждому кодону соответствует только одна определенная аминокислота;
4. вырожденность – возможность кодирования одной и той же аминокислоты несколькими кодонами;
5. неперекрываемость – кодоны считываются последовательно, один за другим, не перекрываясь;
6. однонаправленность - декодирование мРНК осуществляется в направлении 5`→3`;
7. колинеарность – соответствие последовательности аминокислот в белке последовательности нуклеотидов в зрелой мРНК;
8. существование нескольких типов кодонов – инициирующего (АУГ), смысловых и терминирующих (УАА, УАГ, УГА).
Для осуществления синтеза белка необходимо согласованное взаимодействие большого числа компонентов (Табл. 7.1.).
Таблица 7.1. Компоненты белок-синтезирующей системы
| Компоненты | Функции |
|---|---|
| Аминокислоты | Субстраты для синтеза |
| тРНК | Адапторы, обеспечивающие доставку и включение нужной аминокислоты в белок |
| Аминоацил-тРНК-синтетазы | Обеспечение специфического связывания аминокислоты с соответствующей тРНК |
| мРНК | Матрица для синтеза |
| Рибосомы | Место синтеза белка |
| АТФ, ГТФ | Источники энергии |
| Факторы инициации, элонгации, терминации | Внерибосомные белки, необходимые для соответствующих этапов трансляции |
| Mg | Кофактор, стабилизирующий структуру рибосом. |
Синтез белка происходит в несколько стадий:
1. подготовка к синтезу, заключающаяся в активации аминокислот и образовании аминоацил-тРНК;
2. собственно трансляция, состоящая из этапов инициации, элонгации и терминации;
3. посттрансляционная модификация белка.
Активация аминокислот
На стадии подготовки к синтезу каждая из 20 протеиногенных аминокислот присоединяется α-карбоксильной группой к 2'- или 3'-гидроксильному радикалу акцепторного конца соответствующей тРНК с образованием сложноэфирной связи. Эти реакции, происходящие в цитозоле, катализирует семейство аминоацил-тРНК-синтетаз (аа-тРНК-синтетаз). Каждый фермент этого семейства узнаёт только одну определенную аминокислоту и те тРНК, которые способны связаться с этой аминокислотой. Аминоацил-тРНК-синтетазы активируют аминокислоты в 2 стадии. В ходе первой аминокислота присоединяется к ферменту и реагирует с АТФ с образованием богатого энергией промежуточного соединения – аденилата. На второй стадии аминокислотный остаток аминоациладенилата, оставаясь связанным с ферментом, взаимодействует с молекулой соответствующей тРНК с образованием аминоацил-тРНК. Энергия, заключенная в макроэргической связи аминоацил~тРНК, впоследствии используется на образование пептидной связи в ходе синтеза белка.
Высокая специфичность аа-тРНК-синтетаз в связывании аминокислоты с соответствующими тРНК лежит в основе точности трансляции генетической информации. В активном центре этих ферментов есть 4 специфических участка для узнавания: аминокислоты, тРНК, АТФ и четвертый – для присоединения молекулы Н2О, которая участвует в гидролизе неправильных аминоациладенилатов. То есть, в активном центре этих ферментов существует корректирующий механизм, обеспечивающий немедленное удаление ошибочно присоединенного аминокислотного остатка.